Apeiron: Rekombinantes Protein wird gegen COVID-19 getestet
Das Wiener Biotechnologie-Unternehmen Apeiron beginnt eine klinische Studie der Phase II in Österreich, Deutschland und Dänemark, bei dem das rekombinante Protein rhACE2 an 200 schwer erkrankten COVID-19-Patienten getestet werden soll.
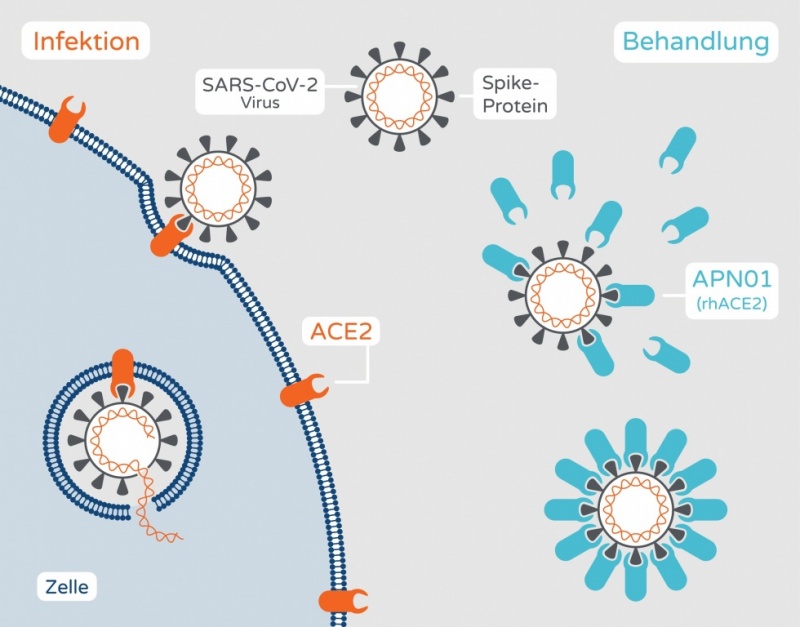
rhACE2 (Projektname APN01) ist die rekombinante Variante des membrangebundenen Enzyms ACE2 (Angiotensin-konvertierendes Enzym 2), das eine wichtige Rolle bei der Regulation des Salz- und Wasserhaushalts des Körpers sowie des Blutdrucks spielt. Der Wirkstoff wurde, ausgehend von dieser Funktion, von Apeiron zur Behandlung schwerwiegender Lungenerkrankungen wie des akuten Atemnotsyndroms (ARDS) entwickelt, das als eine der Komplikationen bei COVID-19-Patienten auftritt. ACE2 dient aber auch als Rezeptor, an dem Coronaviren der Spezies SARS-CoV an die Wirtszelle andocken, deren Vertreter sowohl die SARS-Epidemie 2003 als auch den derzeitigen Ausbruch von COVID-19 verursacht haben. Bindet das Virus an die lösliche rekombinante Variante anstatt an den Zellrezeptor, wird verhindert, dass dieser die Zelle befällt.
Apeiron-Vorstandsvorsitzender Peter Llewellyn-Davies spricht daher von einem „einzigartigen dualen Wirkmechanismus“, durch den APN01 zum ersten Medikament werden könnte, das spezifisch gegen SARS-CoV-2 gerichtet ist. Die Aufsichtsbehörden in Österreich, Deutschland und Dänemark haben nun die Genehmigung zum Start einer klinischen Phase II-Studie erteilt, in deren Rahmen der Arzneimittelkandidat an 200 schwer an COVID-19 erkrankten Patienten getestet werden soll. Die Placebo-kontrollierte randomisierte Doppelblindstudie wird an zehn Standorten in Österreich, Dänemark und Deutschland durchgeführt. Primäres Ziel ist die Bewertung der klinischen Wirksamkeit sowie der Sicherheit und Verträglichkeit von APN01. Sekundäre Zieles sind die Evaluierung von Veränderungen messbarer biologischer Parameter nach der Verabreichung.
Am 26. Februar hatte Apeiron bekannt gegeben, eine klinische Pilotstudie mit APN01 in China beginnen zu wollen, die als Grundlage für die Durchführung einer klinischen Phase-IIB-Studie mit einer größeren Anzahl von Patienten dienen sollte. Eine Genehmigung des lokalen Ethikrates für diese Vorhaben lag vor. „Bevor die Studie jedoch starten konnte, hat die chinesische Regierung die Zulassungsregelungen verändert und lässt nur noch Studien mit Genehmigung der nationalen Behörden zu“, heißt es von Seiten Apeirons dazu. Ein Antrag für eine Phase-II-Studie in China sei in Arbeit, derzeit konzentriere man sich aber auf den aktuellen Hotspot Europa.
Über APN01
Die Forschungen zur Rolle von ACE2 von Apeiron-Gründer Josef Penninger waren einer der Ausgangspunkte für die Gründung des Unternehmens. 2010 wurden die Rechte an APN01 an Glaxo Smith Kline auslizenziert. Der Pharmakonzern führte von 2014 bis 2017 Studien zur Behandlung von Lungenerkrankungen durch. 2019 erhielt Apeiron die Lizenzen für die weitere klinische Entwicklung zurück, nachdem GSK sich strategisch auf die Onkologie konzentriert hatte.
