Gespeichert von sachs am/um
Hauptbild
Die Validierung einer Analysenmethode stößt schon beim oftmals ersten Schritt, der Extraktion der Analyten, auf Schwierigkeiten bei der Überprüfung. Sind zertifizierte Referenzmaterialien verfügbar, ist diese Hürde rasch genommen. In den vielen anderen Fällen muss auf Ersatzlösungen ausgewichen werden.
Von Wolfgang Brodacz, AGES Österreichische Agentur für Gesundheit und Ernährungssicherheit, Linz
Eines der wichtigsten Leistungskennzeichen einer analytischen Methode ist die sogenannte Wiederfindung bzw. Rückgewinnung. Sie definiert, wie viel von der bekannten Menge eines Zielanalyten gefunden wird. Bei der Validierung einer Methode kann diese Kennzahl auf zwei Arten bestimmt werden: Idealerweise besitzt man ein Probenmaterial, von dem der „wahre Wert“ bekannt ist – ist das nicht der Fall, präpariert man sich künstlich hergestelltes Testmaterial.
Im ersten Fall handelt es sich um sogenanntes zertifiziertes Referenzmaterial, dessen Gehalt anerkannt ist. Welche Schwierigkeiten der zweite Fall aufwirft, wird im Anschluss erläutert. Die Problematik besteht in verschärfter Form bei der Rückstandsanalytik im Spurenbereich. Die erforderlichen Wiederfindungstests für Verfahrensschritte wie dem Clean-up etc. lassen sich durch gezielte Dotierung mit einer Analytlösung („Spiken“) praktisch noch gut überprüfen. Eine Kontrolle der Extraktionseffizienz von „natürlich gewachsenen“ Schadstoffen wie z.B. von Mykotoxinen in Zerealien oder gealterten Rückständen (Pestizide im Boden) ist indes bedeutend problematischer. Das Spiken von zielanalytfreier Matrix birgt das Problem der inhomogenen Verteilung in Feststoffen. Je größer das dafür verwendete Lösungsmittelvolumen ist, desto gleichmäßiger wird zwar die Verteilung, aber desto größer ist auch dessen matrix-verändernder Einfluss und das Problem der Eliminierung des Lösungsmittels. Selbst bei zufriedenstellender Lösung der Dotierproblematik bleibt der prinzipielle Unterschied zwischen „gewachsener“ Kontamination und Spiken. Während das oberflächliche Spiken eine ebensolche Verteilung der Schadstoffe hinterlässt, dürfen bei natürlicher Kontamination „tiefergehende“ Einflüsse wie Bindung an, bzw. Einschluss in die Matrixstruktur angenommen werden. Genügt die Effizienz der bei der Extraktion ablaufenden Vorgänge wie Eindringen, Quellen, Ablösung bzw. Verdrängung, Auflösung, Substanztransport etc. bei gespikten Proben für ausreichende Rückgewinnungen, so besteht bei gewachsenen Kontaminationen keine absolute Gewissheit über eine ebenso vollständige Extraktion.
Zertifiziertes Referenzmaterial
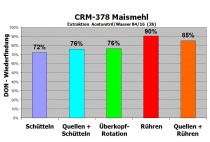
Die einzige zweifelsfreie Messlatte für die Effizienz der Extraktion ist die Verwendung von zertifizierten Referenzmaterialien (CRM). Diese werden meist aus natürlich kontaminierter Matrix gewonnen und durchlaufen sehr aufwendige Überprüfungsverfahren in einer Reihe kompetenter Speziallabors. Mit ausgefeilten statistischen Eignungstests wird nach strengen Kriterien die Zulassung überprüft und das Material abschließend in sehr homogener Form abgepackt. Die garantierte hohe Homogenität und die gut abgesicherten zertifizierten Analysenwerte von CRMs erlauben einen zuverlässigen Vergleich von Extraktionsverfahren.
Abhängig von der Matrix steht eine Vielzahl von Extraktionsmethoden zur Verfügung. Für grob vorzerkleinerte Pflanzen mit hohem Wassergehalt eignen sich naturgemäß schneidende Mixer bis stark dispergierende Spezialgeräte wie ein Ultra-Turrax mit seinen enormen Scherkräften, die auch noch die Zellen aufreißen können. Feststoffe mit geringem Feuchtigkeitsgehalt (getrocknete Böden, Getreide, etc.) müssen zuerst einmal fein vermahlen werden (meist
Spiken von Blanks
Da die Herstellung von CRMs äußerst aufwendig ist, steht für eine sehr große Anzahl von analytischen Fragestellungen kein geeignetes Referenzmaterial zur Verfügung oder die geforderten Matrixtypen bzw. Konzentrationsbereiche weichen zu stark von verfügbaren CRMs ab. In solchen Fällen ist man gezwungen, Kompromisse einzugehen, die den Nachweis der Extraktionseffizienz betreffen. Folgender Vorschlag ist ein Versuch, der Problemstellung z.B. bei Getreide so gut wie möglich gerecht zu werden.
Voraussetzung für einen CRM-Ersatz ist ein sogenanntes Blank-Material, das völlig frei von allen nachzuweisenden Zielanalyten ist. Es kann bei einer Multimethode für z.B. Agrarkontaminanten wie Mykotoxinen schon sehr schwierig sein, völlig unbelastete Zerealien in den notwendigen Varianten (Weizen, Hafer, Gerste, Mais etc.) aufzutreiben. Und je größer die Anzahl der Zielanalyten ist, umso größer ist die Wahrscheinlichkeit, dass doch ein Kontaminant nachweisbar ist. Im Gegensatz zur analogen Pestizid-Fragestellung kann man bei den natürlich produzierten Kontaminanten nicht auf biologisch produzierte Produkte ausweichen.
Das selektierte Blank-Material muss zuerst sehr fein vermahlen werden (kleiner als 0,5 mm), um eine möglichst große Oberfläche zu schaffen. In der dann notwendigen Dotierung verbirgt sich der oben genannte Kompromiss. Es ist praktisch unmöglich, eine größere Menge des Blanks gleichmäßig zu dotieren und eine homogene Verteilung zu erreichen. Daher hat sich in der Praxis bewährt, für jeden einzelnen Rückgewinnungstest einzeln zu spiken. Die entsprechende Einwaage wird also direkt im Extraktionsgefäß mit einem kleinen Volumen so dotiert, dass die Flüssigkeit ausschließlich auf das Probenmaterial trifft und davon gut aufgesaugt wird. Die Spike-Lösung sollte in einem leicht flüchtigen Lösungsmittel angesetzt werden (bei sehr feuchtem Probenmaterial muss es auch mit Wasser gut mischbar sein; z.B. Aceton oder Methanol).
Die Konzentration ist so zu wählen, dass das Spike-Volumen nicht zu gering für eine exakte Dosierung mit z.B. Mikroliter-Spritzen (>100 Mikroliter) ist, aber groß genug, um es möglichst gleichmäßig verteilen zu können. Sehr kleine, hoch konzentrierte Spots müssen unbedingt vermieden werden. Zu viel Volumen würde die Probe durchdringen und auf die Gefäßwand gelangen, bevor das Lösungsmittel verdampft. Ziel ist letztlich eine breite, gleichmäßige Verteilung auf einer großen Materialoberfläche mit Einsickern in die Probenschicht, damit größtmöglicher Kontakt zwischen Zielanalyten und Matrix besteht. Um eine Fixierung der Analyten bestmöglich zu simulieren, sollte der Ansatz dann einige Tage dunkel gelagert werden, damit das Lösungsmittel langsam und vollständig verdampfen kann und die Kontaminanten sich in die Matrixstruktur integrieren.
Für den direkten Vergleich mit der oben gezeigten CRM-Extraktion wurden 32 Zerealien-Blanks einzeln gespiked und nach einigen Tagen mit derselben Rührtechnik extrahiert. Bei Mais (n=16) konnten so durchschnittlich 95 Prozent und bei Weizen (n=16) im Schnitt 100 Prozent der zugesetzten DON-Masse wieder gefunden werden. Die Differenz zu den 90 Prozent beim CRM scheint aus dem unterschiedlichen Bindungsverhalten natürlicher Kontaminationen zu resultieren (nicht berücksichtigt sind hier allerdings eventuelle Unschärfen bezüglich Kalibrier- bzw. Dotierstandards).
Resümee
Viele Jahre Erfahrung des Autors in der Methodenentwicklung für die Pestizidanalytik haben speziell bei schwierigen Matrizes wie diversen Boden-Typen gezeigt, dass diese Vorgangsweise notwendig ist. Denn bestimmte polare Herbizide konnten wenige Stunden nach dem Spiken problemlos und vollständig extrahiert werden. Hat der Boden aber z.B. zwei Tage Zeit, die Pestizide zu binden, konnte von manchen Wirkstoffen nur noch ein kleiner Teil in Lösung gebracht werden. Das zeigt deutlich, dass Rückgewinnungsversuche durch Spiken und sofortiges Extrahieren nicht geeignet sind, verlässliche Informationen über die tatsächliche Extraktionseffizienz eines Verfahrens bereitzustellen, obwohl sie „gefällige“ Rückgewinnungsraten liefern.
In diesem Zusammenhang ist auch interessant zu erwähnen, dass das Quellenlassen von trockenen Materialien wie Böden die Ablösung von polaren Zielanalyten dramatisch verbessern kann. Die Wassermoleküle besetzen dabei anscheinend die polaren Oberflächenstellen und verdrängen damit die fixierten Analyten. Ein Extrembeispiel ist die Hexan-Extraktion von Perchlorethylen in Tiermehl, bei der ohne Quellung mit Wasser nur ein Bruchteil gefunden werden kann.
Grundsätzlich ist bei Vergleichen jene Extraktionsvariante die geeignetere, die aus natürlich kontaminiertem und homogenem Material „mehr herausholt“. Ob das dann auch wirklich „alles war“, kann zuverlässig nur mit zertifiziertem Referenzmaterial festgestellt werden.