Gespeichert von sachs am/um
Hauptbild
Von Wolfgang Brodacz, AGES Österreichische Agentur für Gesundheit und Ernährungssicherheit, Kompetenzzentrum Cluster Chemie Linz
Die Maximierung des Probenaufgabevolumens bringt nicht nur Vorteile für die Nachweisempfindlichkeit einer chromatographischen Methode. Unter Umständen kann man sich so einen aufwendigen Konzentrierungsschritt oder andere Manipulationen ersparen. Der Gefahr verbreiteter bzw. zerstörter Peakformen muss allerdings entgegengewirkt werden.
Die Steigerung des Injektionsvolumens nutzt die oft wertvolle oder rare Probenmenge besser aus. Das ist z.B. von besonderer Bedeutung, wenn kostbare isotopenmarkierte Standards im Laufe der Aufarbeitung als interne Standards zugemischt werden müssen (1). Die Wirtschaftlichkeit verbessert sich dann mit sinkenden Messlösungsvolumen und steigendem Injektionsanteil. Auch bei der im Chemiereport.at 5/2011 (2) vorgestellten automatisierten Dotierung des internen Standards im Autosampler ist durch die Halbierung der nutzbaren Kapazität die Maximierung des Injektionsvolumens umso wichtiger. Als Anhaltspunkt für die optimale Aufgabenmenge gibt es verschiedene Richtlinien, denn die Überschreitung dieser Grenzen muss mit gestörten Peakformen bezahlt werden.
Grundsätzlich trägt jede Probenaufgabe zur Bandenverbreiterung bei. Um diese möglichst gering zu halten, sollte aus rein chromatographischer Sicht das Injektionsvolumen minimiert werden. Der resultierende Zielkonflikt muss mit der Tolerierung eines bestimmten Bodenzahlverlustes gelöst werden. Als grober Anhaltspunkt für die am weitesten verbreitete Reversed Phase-LC (RP; C-18) kann z.B. die Faustregel von Prof. Welsch (3) gesehen werden. Seine Abschätzung des Probenvolumens geht von einer Säule mit ca. 10.000 Böden aus und nimmt eine Reduktion der Bodenzahl von ca. 10 % in Kauf:
Injektionsvolumen (µl) = 5 * Retentionszeit (min) * Flussrate (ml/min)
Bei einer Erhöhung des Injektionsvolumens von 20 auf 80 µl reduziert sich die Auflösung z.B. um ca. 26 Prozent (Säule: 125 * 4 mm; 5 µm; 1 ml/min) (3).
Hauptkriterium Elutionsstärke
Trotz aller Regeln und Richtlinien kommt man bei der Methodenentwicklung um eine empirische Optimierung nicht herum. Dabei wird manchmal übersehen, dass die Zusammensetzung der Probenlösung im Verhältnis zum Eluenten von besonderer Bedeutung ist. Entscheidend ist die Elutionsstärke, und damit ist in der RP-Chromatographie der organische Anteil am Injektionsvolumen ausschlaggebend. Bei isokratischen Trennverfahren darf die Zusammensetzung der Probe ohne weiteres der des Eluenten entsprechen. Dann können auch die üblichen Volumen ohne besondere Einschränkungen verwendet werden.
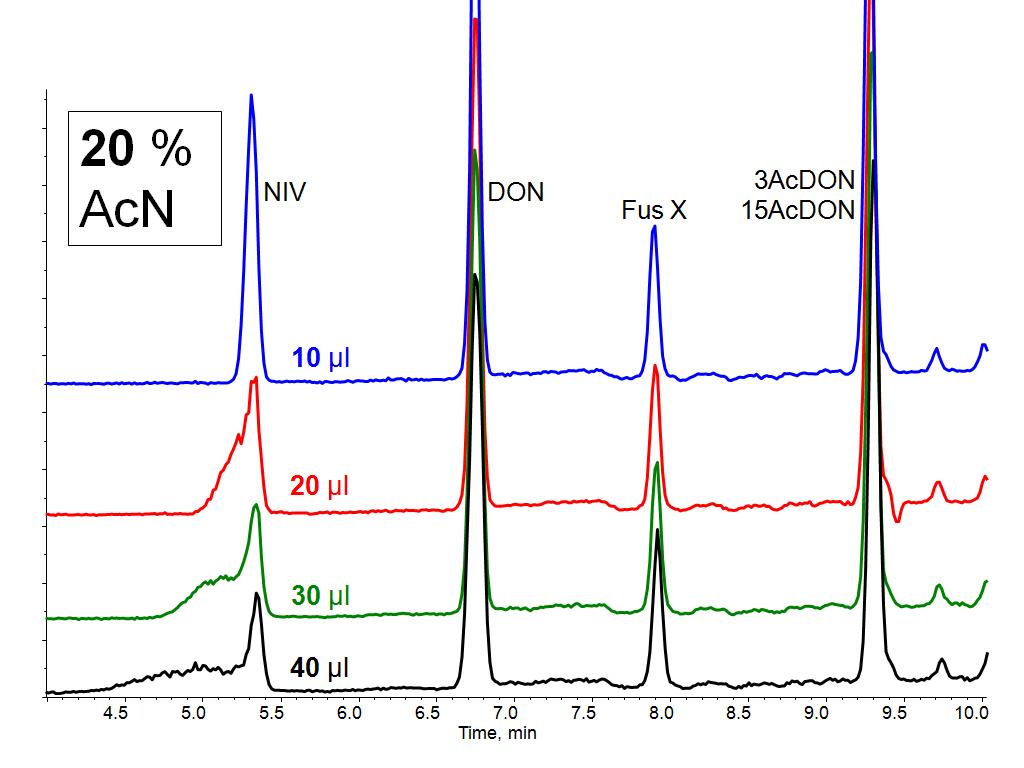
Abbildung 2: Injektionsvolumen versus Peakform bei mittlerer Elutionskraft der Probe (ESI-LC/MS-MS)
Ist der organische Anteil der Probe deutlich geringer als der des Eluenten, so ist die Probemlösung „chromatographisch schwächer“ und es darf das Injektionsvolumen sogar etwas erhöht werden, ohne die chromatographische Trennung gravierend zu stören (teilweise Aufkonzentrierung der Analytenzone am Säulenkopf). In der überwiegenden Anzahl der Fälle handelt es sich in der RP-LC beim organischen Anteil um Methanol oder Acetonitril (selten Isopropanol, Ethanol oder Tetrahydrofuran). Bei kritischen Trennungen sollte übrigens beachtet werden, dass Acetonitril eine um ca. 10 Prozent höhere Elutionskraft als Methanol besitzt. Ist die Probe aber „stärker“, d.h. der relative Anteil an nichtwässrigen, unpolaren Komponenten ist höher als im Eluenten, muss das Injektionsvolumen entsprechend reduziert werden. Denn durch die lokale Überladung der Säule werden die Peaks proportional zum Injektionsvolumen verbreitert.
Bei einem Gradientensystem wirken sich diese Zusammenhänge noch deutlicher aus. Gradienten beginnen meist mit einem sehr geringen organischen Anteil von z.B. 10 Prozent und enden dann meist mit 90 Prozent. D.h. der hohe Wasseranteil in der Injektionsphase erfordert eine entsprechend „schwache“ Probenzusammensetzung oder eine Reduktion des Injektionsvolumens bei höherem organischen Anteil. Die Missachtung dieser einschränkenden Zusammenhänge trifft in erster Linie die früheluierenden Analyten in Form von Peakverbreiterungen bis zu massiven Deformationen, sodass die erste Substanz manchmal gar nicht mehr als Peak erkannt werden kann. Es ist einleuchtend, dass der Analyt mit der geringsten Retention am stärksten unter der höheren Elutionskraft des injizierten Volumens „leidet“.
Bei der LC-Methodenentwicklung muss daher als erstes die Frage geklärt werden: In welcher Lösungsmittel-Zusammensetzung muss oder soll meine Probe anfallen? Abhängig von der Probenvorbereitung können sich fixe Vorgaben durch Extraktionsmittel, Clean up-Verfahren etc. ergeben, sodass der Spielraum für eine gezielte Zusammensetzung der Messlösung mehr oder weniger eingeschränkt wird. Bei vordefinierter Komposition der Messlösung kommt nur noch die experimentelle Ermittlung des maximalen Injektionsvolumens in Frage. Bei hohem organischen Anteil wird dieses ungünstigerweise sehr klein ausfallen müssen.
Besteht bei der Gestaltung der Zusammensetzung genügend Spielraum, ist folgende Vorgangsweise zweckmäßig:
- Welcher organische Minimalanteil ist notwendig, um meine Zielanalyten noch sehr gut zu lösen (ohne dass sie z.B. bei Abkühlung an der Gefäßwand ausfallen etc.)?
- Welche Zusammensetzung ergibt sich bei einer Minimierung von manuellen Verfahrensschritten bei der Aufarbeitung (d.h. Vermeidung von Konzentrierungen, Lösungsmittelwechsel etc.)?
Aus der resultierenden Bandbreite sollte man sich an der chromatographisch schwächeren Seite orientieren, damit das Aufgabevolumen nicht eingeschränkt werden muss.
Injektionsvolumen versus Peakbreite
Am folgenden Praxis-Beispiel der Entwicklung einer Mykotoxin-Multimethode sollen die Auswirkungen abgestufter Messlösungs-Zusammensetzungen bei verschiedenen Injektionsvolumen auf die Peakform der Früheluierenden demonstriert werden. (Aus Gründen der Anschaulichkeit sind nur die ersten 4 Peaks dargestellt. Die später eluierenden sind praktisch nicht mehr betroffen). Für die LC-Injektionsoptimierung wurden aus Literaturangaben praxisnahe Spannweiten ausgewählt, wie in der Tabelle angegeben miteinander kombiniert und dann experimentell getestet. Die Konzentrationen der Analyten wurden in den zehn abgestuften Messlösungen so gestaltet, dass bei jeder Injektion die gleiche Absolutmenge an Analyten aufgegeben wird. Dadurch ergeben sich gleiche Peakflächen und Verbreitungseffekte können zusätzlich leichter an den reduzierten Peakhöhen erkannt werden. Der Gradient aus Eluent A (10 Prozent Methanol in Wasser) und Eluent B (97 Prozent Methanol in Wasser) startet zwei Minuten lang nur mit dem wässrigen Laufmittel A und steigert dann innerhalb von 12 Minuten den organischen Eluenten B von 0 auf 100%. Die zeitgesteuerte Mischung wurde mit 1 ml/min auf eine RP-Säule (C-18; 150 * 4,6mm; 5µm) gebracht, der Eluentenzusatz von 1 Prozent Essigsäure und 5 millimolarer Ammoniumacetat-Lösung dient der Elektrospray-Ionisierung (4).

Abbildung 3: Vergleich der akzeptablen, maximierten Injektionsvolumen bei verschiedenen Elutionsstärken der Probe (ESI-LC/MS-MS)
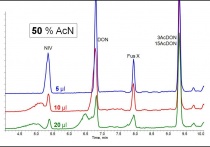
Die Chromatogramme in Abbildung 1 repräsentieren verschiedene Injektionsvolumen bei einer Probenzusammensetzung von 50 Prozent Acetonitril / 50 Prozent Wasser. Bei diesem Beispiel für einen relativ hohen organischen Anteil zeigen sich massive chromatographische Störungen des polaren Ersteluierenden (NIV) ab einem Volumen von 5 µl. Bei 10 µl ist auch schon DON betroffen und ab 20 µl kommt es bei den ersten drei Peaks zu starken Deformationen. Als Beispiel für einen mittleren organischen Anteil (20 Prozent Acetonitril / 80 Prozent Wasser) sind vier steigende Infektionsvolumen in Abbildung 2 gegenübergestellt. Während 10 µl noch gute Peakformen zeigen, hinterlassen größere Aufgabenmengen von Acetonitril zunehmende Peakdeformationen beim gering retardierten NIV. Die lokalen Überladungen wirken sich bei 20 Prozent organischem Anteil aber nicht mehr auf den zweiten Peak aus. Die jeweils empirisch ermittelten maximalen Injektionsvolumen der unterschiedlichen Messlösungszusammensetzungen („best of“) sind in Abbildung 3 gegenüber gestellt. Dabei wird deutlich, dass bei 50 Prozent Acetonitril selbst die Reduktion auf 5 Mikroliter noch nicht ausreicht, um NIV sauber zu chromatographieren.
Für die Praxis wird schließlich eine Probenlösung mit 10 Prozent Acetonitril in Wasser gewählt und daraus werden 40 µl injiziert. Bei guten symmetrischen Peakformen wird damit ein Maximum an Probenaliquot ausgenutzt und in die Nachweisempfindlichkeit investiert. Noch wichtiger ist in der Praxis die Vermeidung eines Konzentrierungsschrittes bei der Aufarbeitung.
(1) W. Brodacz, „ Kostenreduktion in der Stabilisotopenverdünnungsanalytik - Qualität verbessern und trotzdem sparen“; Chemiereport.at 4/2011
(2) W. Brodacz, „Stabilisotopenverdünnung direkt im Autosampler - Der Königsweg in der MS-Quantifizierung “; Chemiereport.at 5/2011
(3) T. Welsch, „Packungstechnologie und Säulendesign für hohe Auflösung, Geschwindigkeit und Massenempfindlichkeit in der HPLC“; Institut für Analytische und Bioanalytische Chemie, Universität Ulm; 27. Agilent Forum Analytik; Wien 2011
(4) Sulyok M., Berthiller F., Krska R., Schuhmacher R., „Development and validation of a liquid chromatography/tandem mass spectrometric method for the determination of 39 mycotoxins in wheat and maize”, Rapid Commun. Mass Spectrom. 20, 2649-2659, 2006